Evaluación cinética y estructural de la reducción de peroxirredoxinas humanas de 2 cisteínas por tioredoxinas
Resumen
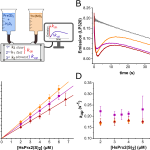
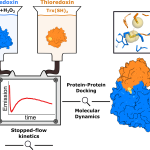
Estudiamos las reacciones de reducción de dos peroxirredoxinas (Prx) humanas citosólicas (HsPrx1 y HsPrx2) en su forma de disulfuro por tres tioredoxinas (Trx; dos humanas y una bacteriana), con el objetivo de entender mejor la velocidad y el mecanismo de esas reacciones, así como su relevancia en el contexto del ciclo catalítico de peroxirredoxinas. Hemos desarrollado una nueva metodología basada en el uso de un equipo de flujo detenido detectando fluorescencia intrínseca de proteínas, para estudiar las reacciones bimoleculares.
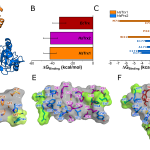
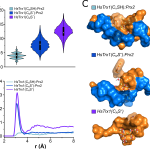
Al combinar estos hallazgos con estudios de dinámica molecular, encontramos que la reactividad de la cisteína nucleofílica (CN) en la Trx se ve fuertemente afectada por la formación del complejo Prx-Trx. La interacción proteína-proteína fuerza al tiolato de CN hacia un microambiente hidrofóbico desfavorable que reduce su hidratación y resulta en una notable aceleración de las reacciones de intercambio tiol-disulfuro en más de tres órdenes de magnitud, además de producir un cambio medible en el pKa del CN. Este mecanismo de activación del intercambio tiol-disulfuro puede ayudar a entender la reducción de Prx por reductores alternativos involucrados en la señalización redox. Esto nos permitió conocer más sobre los movimientos moleculares detrás del mecanismo de reducción de disulfuros por Trx, algo que no había sido estudiado con tanto detalle hasta el momento.